представить (кого-л. на работу и т.д.)
Основные лаборатории, предлагающие разнообразные услуги по секвенированию следующего поколения (NGS), связанные с широким кругом клиентов, типов образцов и методов секвенирования, должны обеспечивать баланс между эффективностью рабочих процессов NGS и качеством получаемых данных. По мере снижения стоимости секвенирования расходы, связанные с подготовкой библиотек, начинают составлять значительную часть общей стоимости рабочего процесса NGS. Чтобы решить эту важную проблему стоимости секвенирования, многие организации следуют тенденции миниатюризации реакций, фактически сокращая объемы реакций до рекомендованного производителем объема 10%.
В этой прикладной записке описывается рабочий процесс для создания высококачественных библиотек NGS с помощью точного микрофлюидного дозирования реагентов с положительным смещением, даже при малом количестве клеток. Данные контроля качества, полученные при подготовке библиотеки Illumina Nextera XT объемом четверть объема, демонстрируют применимость и эффективность миниатюризации реакций в контексте секвенирования одноклеточных.
Материал.
- Планшет Eppendorf twin.tec 384 (PN 0030129342)
- Набор для подготовки библиотеки ДНК Illumina Nextera XT (PN FC-131-1096)
- Illumina Nextera XT Index Kit V2 (FC-131-2001)
- термоциклер
- Жидкостный процессор FORMULATRIX® MANTIS® (PN MANTV3.2)
- Магнитная пластина для колонок Alpaqua 384 (PN A001222)
- Флуорометр ThermoFisher Qubit 4 (PN Q33226)
- Биоанализатор Agilent 2100 (PN G2939BA)
Методы
Подготовка библиотеки Illumina Nextera XT в четверть объема
Восемь образцов кДНК клеток нейронов мыши (три типа клеток; 1 нг исходной ДНК) были использованы в этом пилотном проекте, и качество библиотек, созданных в четверть объема, затем было оценено по следующему экспериментальному протоколу:
**А. Тегментированная кДНК - общий объем реакции 6,35 мкл **.
Добавьте 1,25 мкл исходной ДНК в лунки 384-луночного микротитровального планшета.
Наберите буфер TD Buffer в наконечник пипетки объемом 200 мкл* и поместите его на чип LV прибора MANTIS. Внесите 2,5 мкл буфера TD в каждую лунку микропланшета MANTIS, содержащую образец.
Микс.
Наберите ATM в наконечник пипетки объемом 200 мкл* и поместите на чип LV прибора MANTIS. Внесите 1,3 мкл ATM в каждую лунку с образцом на микропланшете MANTIS.
Микс.
Термоциклирование.
i. Выдержите при 55°C в течение 5 минут
ii. 10°C во все последующее время
Наберите буфер NT в наконечник пипетки объемом 200 мкл* и поместите его на чип LV прибора MANTIS. Внесите 1,3 мкл буфера NT в каждую лунку микропланшета MANTIS, содержащую образец.
Микс.
Инкубируйте при комнатной температуре в течение 5 минут.
B. Амплификация библиотеки - общий объем реакции 12,65 мкл
Наберите NPM в наконечник пипетки объемом 200 мкл* и поместите на чип LV прибора MANTIS. Внесите 3,8 мкл в каждую лунку с образцом на микропланшете MANTIS.
Вручную пипетируйте 1,25 мкл обоих индексных праймеров в образец, чтобы получить уникальную комбинацию индексных праймеров для каждого образца.
Микс.
Термоциклирование.
i. 3 минуты при 72°C
ii. 30 секунд при 95°C
iii. Выполните следующие 12 циклов
a. 10 секунд при 95°C
b. 30 секунд при 55°C
c. 30 секунд при 72°C
iv. 5 минут при 72°C
v. 10°C в любое время
C. Уборка в библиотеке
1. Насыпьте микробисер AMpure XP в наконечник пипетки объемом 200 мкл* и поместите на чип HV прибора MANTIS. Внесите по 10 мкл в каждую лунку с образцом на микропланшете MANTIS.
2. Смешивание.
3. Инкубируйте при комнатной температуре в течение 5 минут
4. Поместите пластину на магнит и подождите 2 минуты.
5. вручную удалите всю надосадочную жидкость (не снимайте микропланшет с магнита до шага 11)
6. Используя функцию непрерывного потока на приборе MANTIS, добавьте 50 мкл 80% EtOH в каждую лунку с образцом на микропланшете.
7. Инкубируйте в течение 30 секунд.
8. вручную удалите всю надосадочную жидкость, поместив микропланшет на магнит.
9. Повторите шаги 6-8. 1. Высушите на воздухе в течение 15 минут. 2. 2. Снимите микропланшет с магнита. 3. 3. Наберите RSB в наконечник пипетки объемом 200 мкл* и поместите на чип HV на MANTIS. 4. Внесите по 15 мкл в каждую лунку с образцом на микропланшете MANTIS. 5. Перемешайте. 6. Инкубируйте при комнатной температуре в течение 2 минут. 7. Поместите микропланшет на магнит. 8. 8. Инкубируйте в течение 2 минут. 9. Вручную перенесите 12,5 мкл из бусин в новый микропланшет.
D. Ингаляционный объем = объем дозирования на образец x количество образцов + коэффициент безопасности 10%. Используйте наконечники для пипеток объемом 1000 мкл для ингаляционных объемов, превышающих 200 мкл.
Результаты.
Качество библиотек Nextera оценивалось для каждого образца с помощью анализатора Agilent BioAnalyzer.
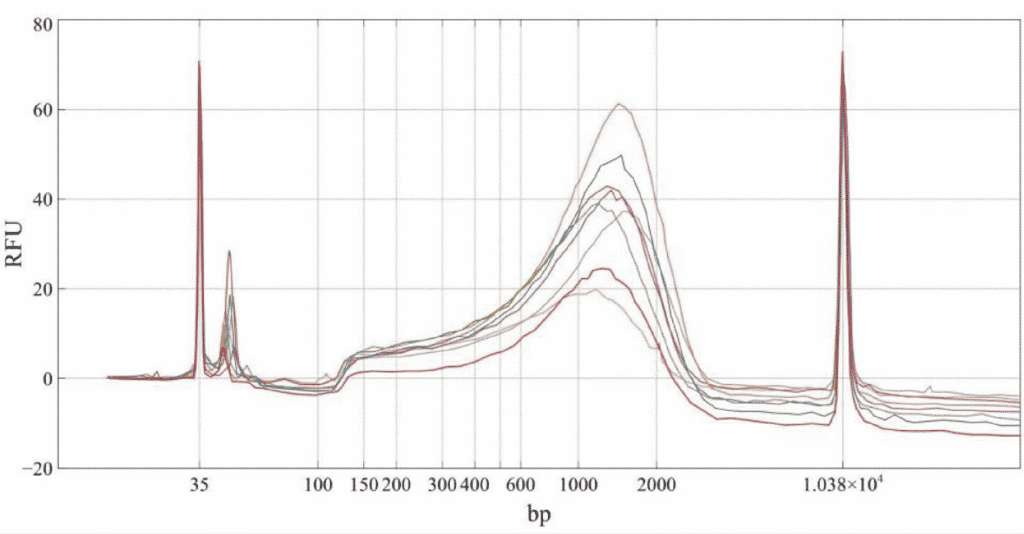
Рисунок 1. Трассировка биоанализатором восьми библиотек секвенирования нового поколения, подготовленных из восьми уникальных образцов кДНК клеток нейронов мыши объемом 1 нг.
Резюме.
Согласно данным, отслеживаемым BioAnalyzer, состав библиотек, приготовленных с помощью миниатюризации четвертьобъемной реакции, является приемлемым и сопоставимым с составом библиотек, приготовленных в соответствии с полнообъемным экспериментальным протоколом.
Приготовление библиотек в четвертом объеме может привести к значительной экономии 75% стоимости набора на реакцию. MANTIS® Liquid Processor для FORMULATRIX® обеспечивает миниатюризацию реакций благодаря точному микрофлюидному дозированию реагентов в объемах до 100 нл, не требует расходных материалов, прост в использовании и надежен.
Источник: @BostonFummerle
Дата: 10 февраля 2022 года
