プレゼンテーション
さまざまな顧客、サンプルタイプ、シーケンスメソッドに関連するさまざまな次世代シーケンス(NGS)サービスを提供するコアラボは、NGSワークフローの効率と生成するデータの質のバランスを取る必要があります。シーケンスコストが低下するにつれ、ライブラリー調製に関連するコストがNGSワークフロー全体のコストの大部分を占めるようになってきています。シーケンスにおけるこの大きなコスト問題に対処するため、多くの組織が反応の小型化のトレンドに従い、反応量をメーカー推奨量の10%まで効果的に減らしています。
このアプリケーションノートでは、細胞投入量が少なくても、精密なポジティブディスプレイスメントマイクロ流体試薬分注で高品質のNGSライブラリーを作製するワークフローを紹介します。1/4容量のIllumina Nextera XTライブラリー調製の品質管理データは、シングルセルシーケンスの文脈における反応の小型化の適用性と有効性を示しています。
素材。
- Eppendorf twin.tec 384 プレート (PN 0030129342)
- イルミナNextera XT DNAライブラリー調製キット(PN FC-131-1096)
- イルミナNextera XTインデックスキットV2(FC-131-2001)
- サーマルサイクラー
- FORMULATRIX® MANTIS® リキッドプロセッサー (PN MANTV3.2)
- Alpaqua 384カラムマグネットプレート(PN A001222)
- サーモフィッシャー キュービット4蛍光光度計 (PN Q33226)
- Agilent 2100 バイオアナライザ (PN G2939BA)
方法論
1/4容量のIllumina Nextera XTライブラリー調製
このパイロット・プロジェクトでは、8つのマウス神経細胞cDNAサンプル(3つの細胞タイプ;1ngのインプットDNA)が使用され、1/4量で生成されたライブラリーの品質は、以下の実験プロトコールによって評価された:
**A. タグメント cDNA - 総反応量 6.35 µL **.
384ウェルマイクロタイタープレートのウェルに1.25μLのインプットDNAを加える。
TD Buffer を 200 µL のピペットチップ* に取り、MANTIS の LV チップにセットします。サンプルを入れた MANTIS マイクロプレートの各ウェルに TD Buffer を 2.5 µL ずつ分注します。
ミックス。
ATMを200µLのピペットチップ*にピペッティングし、MANTISのLVチップ上に置きます。1.3µLのATMをMANTISマイクロプレート上のサンプルを含む各ウェルに分注します。
ミックス。
熱サイクル。
i. 55℃で5分間保持
その後は常に10
200 µL のピペットチップ* に NT Buffer を分注し、MANTIS の LV チップにセットする。サンプルの入った MANTIS マイクロプレートの各ウェルに NT Buffer を 1.3 µL ずつ分注します。
ミックス。
室温で5分間インキュベートする。
B. ライブラリー増幅 - 総反応容量 12.65 µL
NPM を 200 µL のピペットチップ* に吸引し、MANTIS の LV チップにセットする。MANTISマイクロプレートのサンプルを含む各ウェルに3.8 µLずつ分注します。
両方のインデックスプライマー1.25 µLをサンプルに手動でピペッティングし、各サンプルに固有のインデックスプライマーの組み合わせを得る。
ミックス。
熱サイクル。
i. 72℃で3分間
95°C で 30 秒間
iii.次の12サイクルを行う
a. 95℃で10秒
b. 55℃で30秒
c. 72℃で30秒
iv. 72℃で5分間
v. 常時10
C. 図書館の清掃
1.AMpure XPマイクロビーズを200µLピペットチップ*に吸引し、MANTISのHVチップにセットする。MANTISマイクロプレートのサンプルを含む各ウェルに10µLずつ分注します。
2.ミキシング
3.室温で5分間インキュベートする。
4.プレートを磁石の上に置き、2分間待つ。
5.すべての上清を手動で取り除く(ステップ11までマイクロプレートをマグネットから外さないこと)
6. MANTIS の連続フロー機能オプションを使用して、マイクロプレート上の検体を含む各ウェルに 80% EtOH を 50μL ずつ添加します。
7.30秒間インキュベートする。
8.マイクロプレートをマグネットの上に置きながら、すべての上清を手動で取り除く。
9.ステップ6~8を繰り返す。 1.15分間風乾する。 2.マイクロプレートをマグネットから外します。 3. RSBを200µLのピペットチップ*に取り、MANTISのHVチップにセットします。 4. MANTISマイクロプレート上の検体を含む各ウェルに15µLずつ分注します。 5.混合する。 6.室温で2分間インキュベートします。 7.マイクロプレートをマグネットの上に置きます。 8. 2分間インキュベートします。 9. ビーズから12.5 µLを新しいマイクロプレートに手動で移します。
D. 吸入量=サンプルあたりの分注量×サンプル数+10%安全係数。 吸入量が200 µLを超える場合は、1000 µLピペットチップを使用してください。
結果
Nexteraライブラリーの品質は、各サンプルについてAgilent BioAnalyzerトラッキングで評価した。
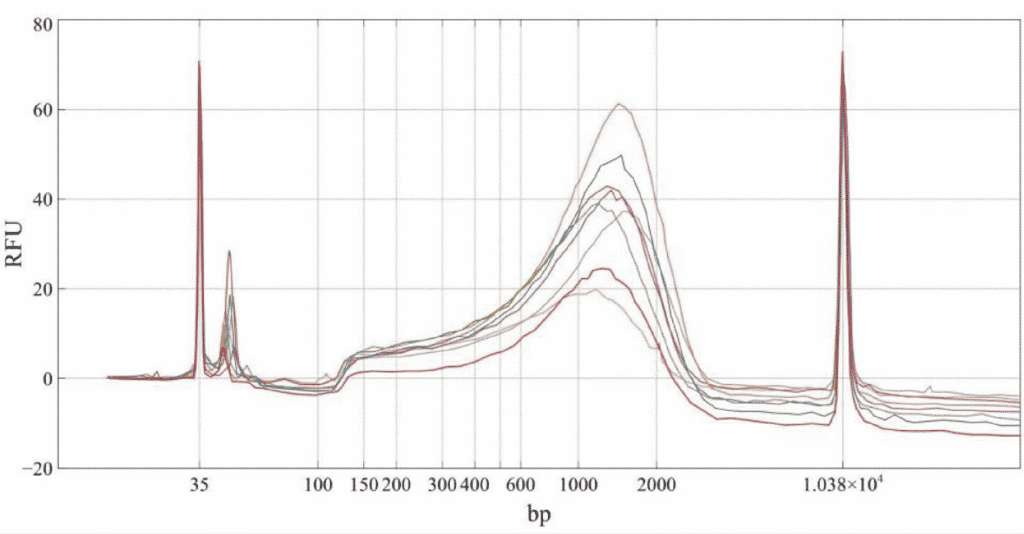
図1. 1 ngのマウス神経細胞cDNAサンプルから調製した8種類の次世代シーケンサーライブラリーのBio nalyzerトレース。
概要
BioAnalyzerのデータ追跡によれば、1/4容量反応による小型化で調製されたライブラリーの組成は許容範囲であり、全量実験プロトコールに従って調製されたものと同等である。
MANTIS®リキッドプロセッサー for FORMULATRIX®は、100 nLという微量での正確なマイクロ流体試薬分注により、反応の小型化を促進し、消耗品なしで、使いやすく、信頼性の高い製品です。
出典:@BostonFummerle
日付:2022年2月10日
